ELISA 技术应用概览和方法学开发初析
简介:
本文适用于已有过 ELISA 应用相关经验,对 ELISA 问题排查和方法开发有进一步需求的广大科研人员,更加适用于 ELISA 相关医疗诊断试剂盒开发,体内药代药动相关大分子检测,抗体结合活性质控等在合规方面有方法学验证要求的药物研发工业领域从业者。ELISA 检测技术的间接性,应用领域的广泛性,样品来源的复杂性和试剂各成分反应过程的可逆性导致ELISA 的方法开发和实际的使用过程中会出现各种异常情况,本文的目的是区分 ELISA 的使用目的,明确目的相关 ELISA 方法的检验标准,分步解析 ELISA 间接检测的信号传递过程以及传递偏差对检测方法的影响,简略探讨免疫反应(配体-受体结合)的化学本质和数学原理,并重新评估棋盘法在 ELISA 方法开发的指导意义,倡导以使用目的为导向通过方法学验证为目标的 ELISA 方法学开发。
ELISA 应用:
ELISA 检测技术早在 19 世纪 70,80 年代就开发出来用于替代放射性同位素标记技术用于研究蛋白质间的相互作用(配体-受体,抗原-抗体),到如今已经接近 50 年的历史了。这个技术从科研的角度来说已经不具备第一性,没有太多的价值,不值得专门进行研究,更多的是一个使用的工具。工业应用落后于基础研究,ELISA 技术在制药领域的应用随着近 20年生物制药领域的迅猛发展展现着越来越多的使用价值,当然 ELISA 的应用情况也越来越复杂,这样的复杂性也使得早期的基础研究并不再具有很好的指导意义, ELISA 方法滥用错用往往导致实验结果出现系统性偏差,影响实验结果的真实性,做出错误的选择。本文的写作目的旨在作为文献之外关于 ELISA 实际应用的一个总结,反补基础研究的不足,使得该技术更具使用价值。 从早期抗体发现阶段,杂交瘤的滴度测定,噬菌体展示的淘选筛选;抗体的稳转,瞬转和发酵过程的表达量监控,体外抗体和对应靶点蛋白或细胞表面受体的亲和力评价,细胞因子的监控,体内抗体药物的药代动力学,药效生物标志物的含量检测和免疫原性测定等均会使用 ELISA 技术。ELISA 技术可以说是一个通用的,入门十分简单,应用面十分广泛,高通量的技术。小木虫,丁香园等关于 ELISA 的问题经久不衰,ELISA 技术由于其检测的间接性(信号进行了多重传递),使用目的的差异性和样品来源的复杂性导致 ELISA 方法一旦出现异常实验地操作者很多时候很难进行问题排除。小编有过多年的 ELISA 相关应用方法学的开发经验,进行了多个 ELISA 应用的开发和方法学验证,从一个 ELISA 方法开发和 ELISA 平台技术搭建者的角度,对 ELISA 方法应用进行梳理和系统分析。
使用目的:
从使用目的来说,ELISA方法可以分为两类。第一类:生物大分子的定量,第二类:亲和力测定评价或者筛选。抗体的稳转、瞬和发酵过程的表达量监控,细胞因子的监控,体内抗体药物的药代动力学,药效生物标志物的含量检测和免疫原性测定等可划分为第一类使用目的,杂交瘤的滴度测定,噬菌体展示的淘选筛选,体外抗体和对应靶点蛋白或细胞表面受体的亲和力评价可划分为第二类使用目的。使用目的不一样,即使使用同样的试剂材料,也会有不同实验模式和拟合曲线。下面小编将以某抗体的定量的方法开发(第一类目的)和亲和力检测方法开发(第二类目的)为例,对不同使用目的开发策略进行介绍。
该方法的检测体系如下,靶点蛋白(抗原)包被,样品(人抗体)进行反应,酶联二抗为羊抗人HRP偶联多抗,显色液为TMB显色液。使用目的是对样品进行定量和亲和力分析。
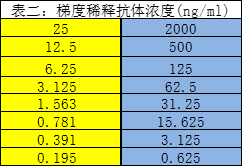
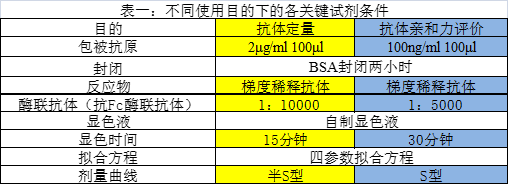
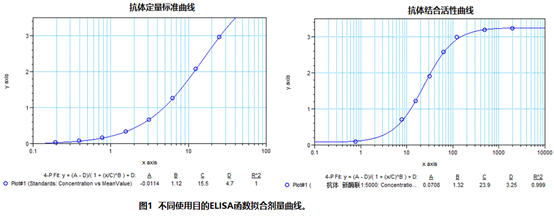
如表一,表二,采用相同的试剂材料,不同的试剂相对浓度得到了如图1不一样的剂量曲线来满足不同的使用目的。而两个方法最核心的不同在于包被抗原的量相对于梯度稀释样品的量,如果一个ELISA需要达到精密,准确等验证需求,在定量方法的开发过程中包被抗原的量要远远大于标准品(样品)的量,这样样品能够抵消抗原抗体可逆反应的影响,使得近似所有的抗体样品均被捕捉到,标准曲线如果做对数线性拟合能够得到非常好的线性。在亲和力评价中,这跟同位素标记测配体受体的亲和力的原理一致,包被少量的包被抗原,采用饱和浸润法即包被抗原的量相对于样品的量是由远远小于抗原的量到远远大于抗原的量的过程,需要有完整的上下渐进线,S型曲线,其EC50即亲和力数值(解离平衡常数)。两个使用目的采取的实验条件涉及到抗原抗体可逆反应化学原理的数学推导,鉴于多写一个数学公式可能会使读者少上不少,公式推导已做省略,不同使用目的的假设推导过程也给出,有志于深耕ELISA领域的读者可以好好研究下。
采用相同的实验材料,不同的试剂配比以分别达到生物大分子定量和亲和力评价的使用目的并进行对比的研究,至目前为止,小编并未在任何文献上见到过类似的研究,但是在实际的应用过程中达到了很好的效果,这也是小编想把这篇文章写下来,期望借助互联网的力量把这个不具有很大的科学价值但是有很广泛的使用价值的技术进行传播讨论,达到越辩越明的目的。
ELISA方法的检验标准:
当然,从一个药物研发从业者的角度来看,开发出来的方法需要进行方法学验证,符合相关法律法规后才能够确认成功,这是从质量分析控制的尺度去对一个ELISA方法进行评估,可以说是最为严格的评估方式。这个工作可能主要集中在质量控制相关的部门,涉及到一个检验方法好坏的评价标准,小编正好也负责过几个ELISA方法的验证工作,简单介绍下,涉及到相关的法律法规,具体实验细节和程序以法规为准。
生物大分子定量方法学验证
当ELISA方法的第一类使用目的是生物大分子定量,这个可以参考2015版中国药典第三部9012 生物样品定量分析方法验证指导原则或者美国FDA最新版本的Guidance for Industry Bioanalytical Method Validation。里面有比较细致关于生物大分子定量方法的准确度,精密度,线性和范围,耐用性等方面的验证要求。在小编看来,在ELISA 定量开发出来后如果初步判断一个检测方法能否通过验证,主要看两点,第一点是标准品的曲线拟合后的回测偏差是否在比较合适和稳定范围内(最佳±10%),第二就要看标准品和待测样品在检测体系中是否具有相同的免疫学特性(平行性)。这个可以通过梯度稀释样品信号代入标准曲线,经稀释倍数校正后测定的浓度值在各稀释倍数是否吻合来判断。相同的免疫学特性是一个非常重要的概念,也是一个方法开发是否成功的关键。免疫学特性不仅仅指的待测样品和包被抗原的亲和力特性,也包含待测样品和酶联抗体的亲和力特性。即使是同样的物质,当样品经过体内代谢循环后其免疫学特性有可能发生改变,那么未经体内代谢的对照品是否能够作为标准品需要经过平行性验证。即使不同的物质,只要有相同的免疫学特性,也能够进行准确定量,小编就搭建了双抗Fc方法(包被为抗Fc抗体,酶联抗体也为抗Fc抗体-HRP)作为通用方法,IGg作为对照品进行多个抗体和融合蛋白的常规检测,经过分子量校准后的检测结果和纯化后紫外的检测结果有可比性。
亲和力测定验证(相对结合活性方法学验证)
亲和力指得是抗体和靶点抗原的解离平衡常数,是一个非常重要的生物特性。在质量控制过程中,常用ELISA方法进行不同批次或者长期稳定性样品的亲和力评价。亲和力一般来说是绝对值,但是由于生物实验的复杂性,材料批次的替换可能会影响到样品的亲和力检测准确性,常会引入一个默认质量属性不会变化的对照品作为参比品,待测样品和参比品一同进行检测来抵消材料造成的偏差,并计算待测样品相对于参比品的亲和力(相对结合活性)。生物功能学方法的评价中国药典目前没有详细的指导标准,只有宏观的分析方法准确度,精密度,线性和范围,耐用性等要求,FDA在USP1032,USP1033,USP1034有比较详细和完整的生物功能学方法验证方案设计,实验结果统计学分析的案例,可以用来评价ELISA建立的亲和力评价方法的质量。
系统分析:信号进行了多重传递和传递过程可能出现的偏差:
ELISA是一个间接的检测过程,这在很多文献资料上都有这样的记载。但是很少有研究资料详细的描述间接测量的信号传递过程,以及传递过程中出现的偏差。这里小编从宏观和微观两个角度对ELISA进行系统分析,该分析有助于搭建稳定的ELISA平台,并正确地使用和评估不同性质的酶联抗体和显色液等通用材料。
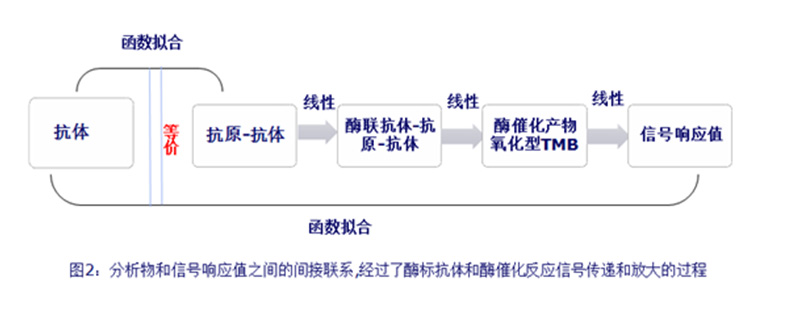
如图2所示,宏观上来讲,ELISA检测的函数曲线在实际操作过程中描述的是剂量浓度的抗体和信号之间的相关关系,而其实质是为了描述剂量浓度的抗体和对应抗原-抗体偶联物之间的相关关系。抗原-抗体偶联物经过了酶联抗体反应和酶催化放大反应,催化产物检测后转换成信号。该信号间接的代表了抗原-抗体偶联物。这种间接的转化过程经历了三重信号的传递过程,而只有在三重传递保证线性的情况,抗体浓度-信号剂量曲线才能等同于抗体浓度-抗体抗原偶联物浓度剂量曲线,如果进行了非线性传递将会影响到整个检测方法的真实性和准确性,下面小编将从微观角度简单介绍下信号传递过程中可能存在的偏差。
1.信号检测偏差:
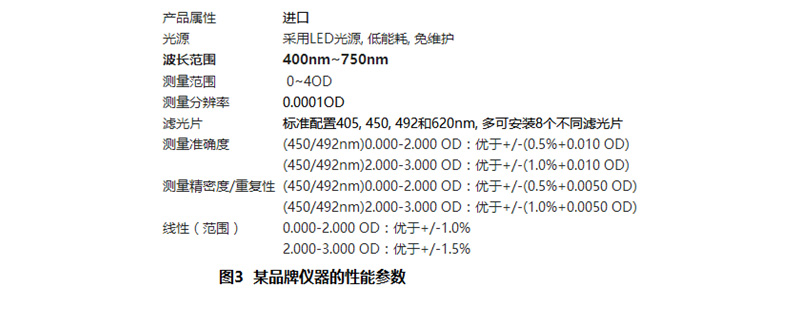
酶催化产物转换成信号时有可能会产生的偏差,这个偏差在一些文献中也称之为仪器的非线性检测区域,即当酶催化产物浓度过高时,催化产物浓度和信号值之间不完全呈线性关系,这个现象是普遍存在的,如图3所示某品牌酶标仪的参数性能,注意该仪器的测量范围是0-4 OD,而该仪器确保的检测线性范围是0-3 OD。一般来讲在进行吸光度法读数时,检测的信号值最高值控制在3左右。如果两个相邻的抗体浓度点对应的信号值在OD值3.5及以上时都会特别接近,这两个信号值很有可能是有信号传递偏差的。这个可以通过高浓度的酶催化产物梯度稀释查看信号的线性范围确认。
2.酶催化反应传递偏差:
该偏差是由酶催化显色液引起的,其实质是酶联抗体的浓度和其对应催化产物的浓度是否线性相关。如图4所示由于酶催化反应在未终止前是一个持续反应的信号放大过程,信号的产生是时间的累积量,在反应过程中酶活可能会丧失(左),显色液的有效成分在不断的减少时,梯度浓度的酶催化反应在反应时间内的可能不会是匀速反应状态(右)。这个可以通过动力学读数进行确认。目前市面上有多种显色液可供选择,显色能力最强和最弱的产品信号差异可能达到20-50倍,需要根据实验的目的正确的选择显色液并确认酶催化过程的线性传递。

3.酶联抗体反应传递偏差:
即酶联抗体和抗体抗原偶联物反应后,酶联抗体-抗原抗体偶联物的浓度能否线性的代表抗体抗原偶联物的浓度。这个比较复杂的过程,主要是因为酶联抗体的异质性导致的,酶联抗体多为多抗,该抗体偶联上的HRP分子数目也存在差异,很难用单一的实验去论证这个线性过程。但值得注意的是,酶联抗体加入反应浓度应该远大于抗体抗原偶联物的浓度,这样能够保证基本所有的抗体抗原偶联物都被转换成酶联抗体-抗原抗体偶联物,酶联浓度加入过少会导致剂量曲线的高浓度点出现假平台期,影响实验的结果;酶联浓度过高可能会导致非特异信号的增加,还有酶联浓度的增加会导致信号的增加,可能会导致信号值超过线性检测范围。所以酶联浓度的反应浓度是一个值得选择的参数。
 网站首页
网站首页