搜索

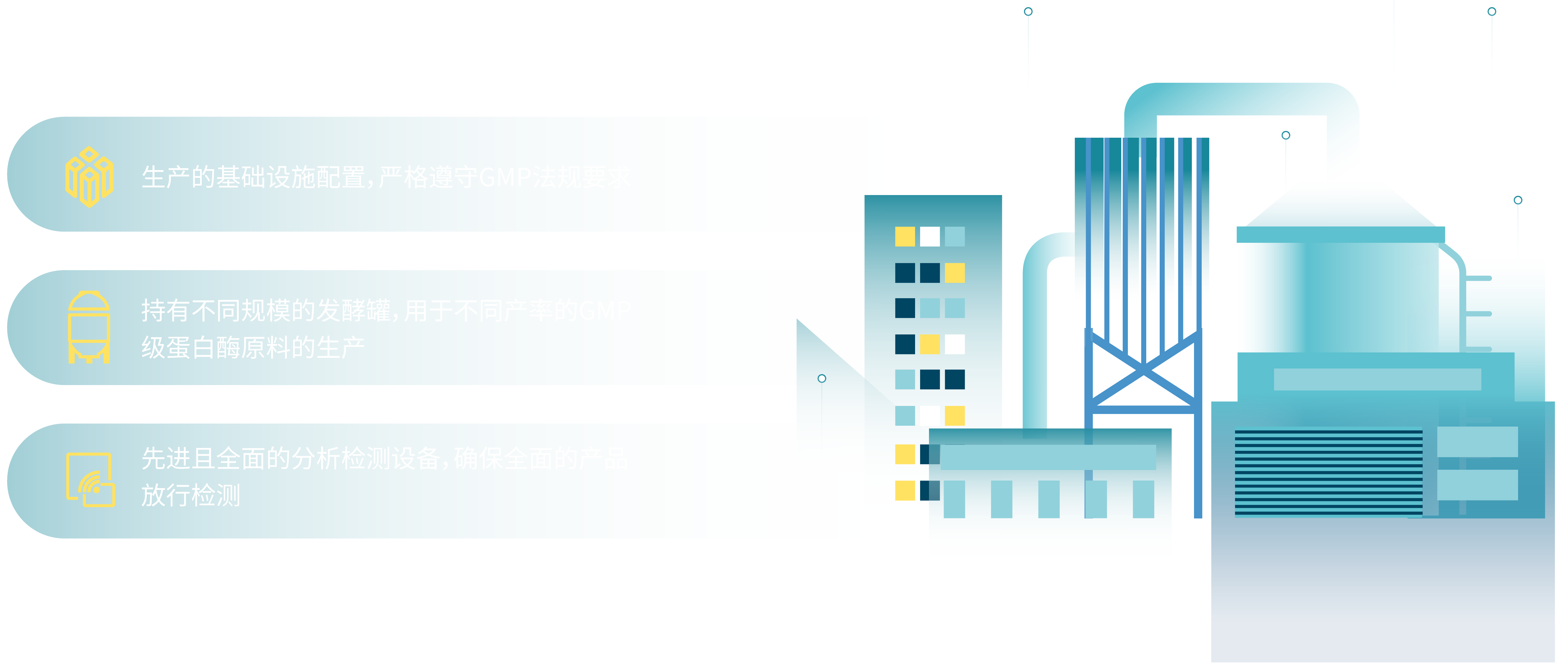
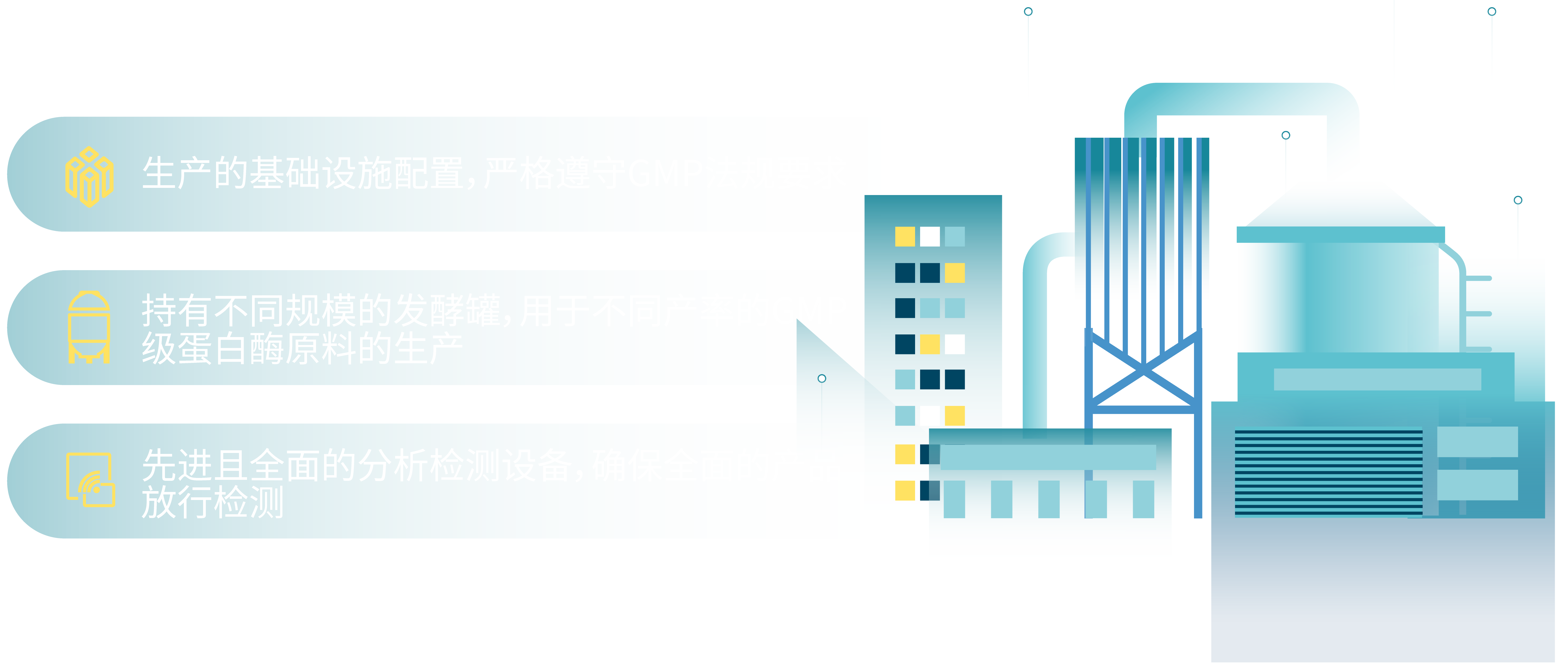
基础设施
质量控制


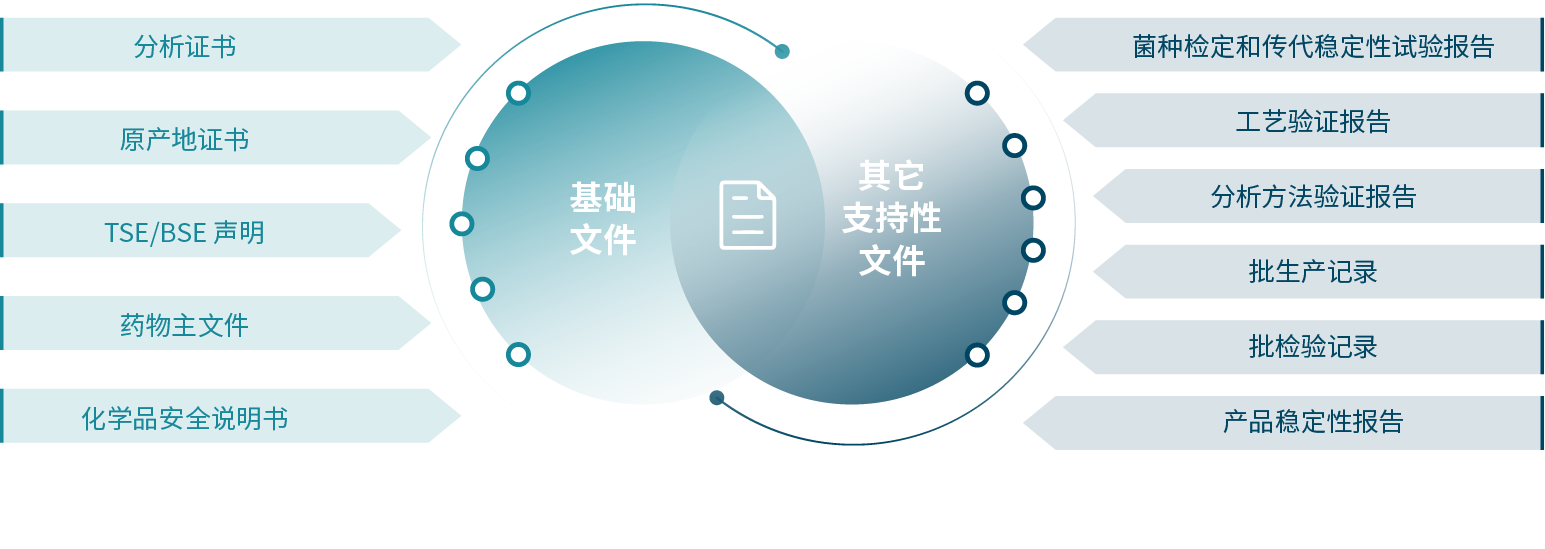
文件支持
我们可以提供相应的基础文件,帮助客户更好的了解我们的产品,此外,如果客户的生物药产品进入申报阶段,我们会根据需求额外提供其他支持性文件,助力客户申报。
全方位的QC检测放行
以GMP级T7 RNA Polymerase为例
活性≥50 kU/ml
蛋白浓度符合要求
纯度≥95%
DNA酶残留阴性
RNA酶残留阴性
蛋白酶残留阴性
重金属残留≤10 ppm
细菌内毒素≤10 EU/ml
宿主DNA残留≤100 pg/mg
宿主蛋白残留≤50 ng/mg
装量≥标示量
微生物限度≤1 CFU/10 ml
镍盐残留≤10 ppm
pH7.9±0.5
样品条带与对照品一致
可见异物符合要求
稳定性研究
我们的稳定性研究内容包括高温试验、光照试验、反复冻融试验、模拟运输试验、加速稳定性试验、批间稳定性研究、长期稳定性研究等,全方位确保产品的稳定性。
以重组S.pyogenes Cas9核酸酶的长期稳定性数据为例

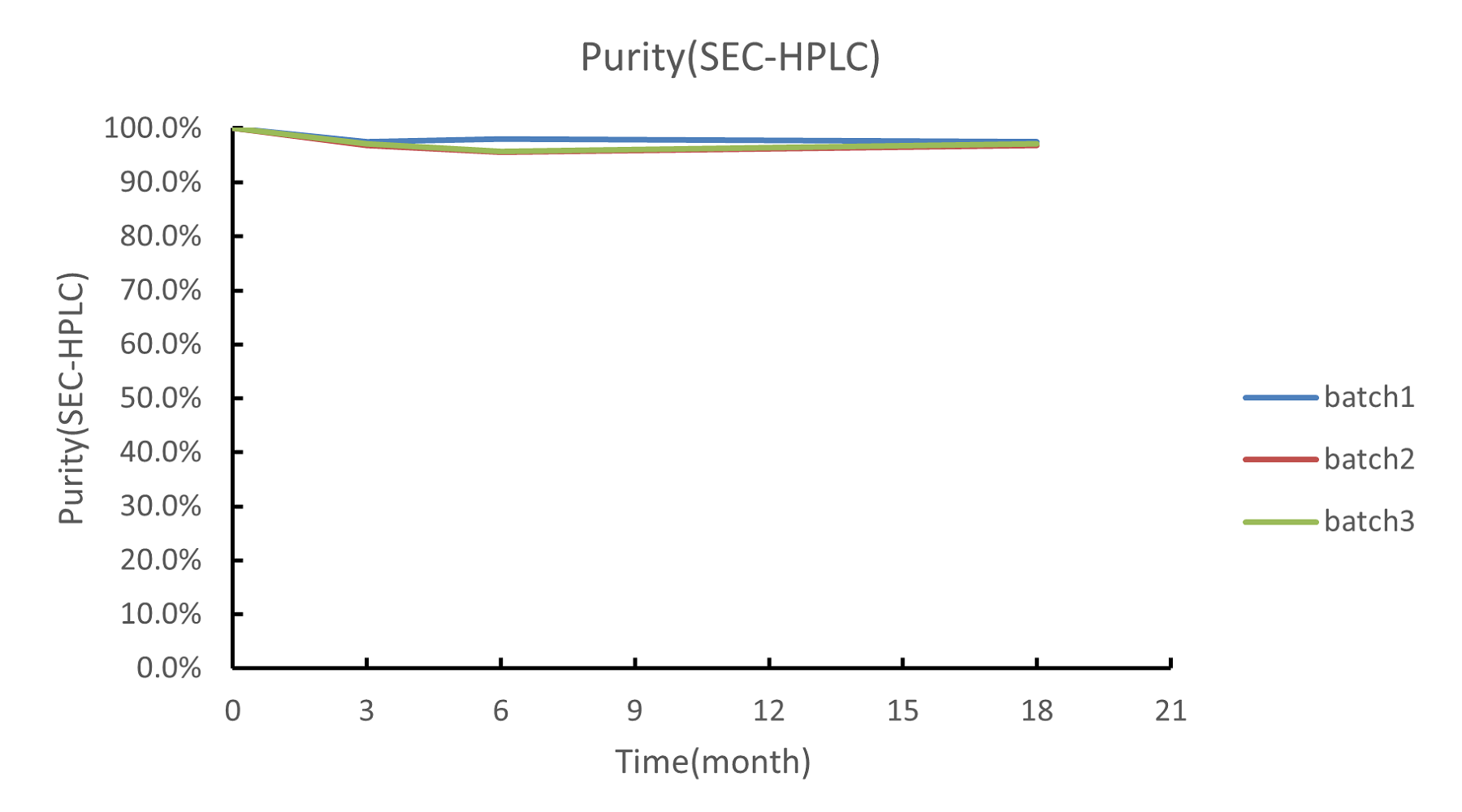
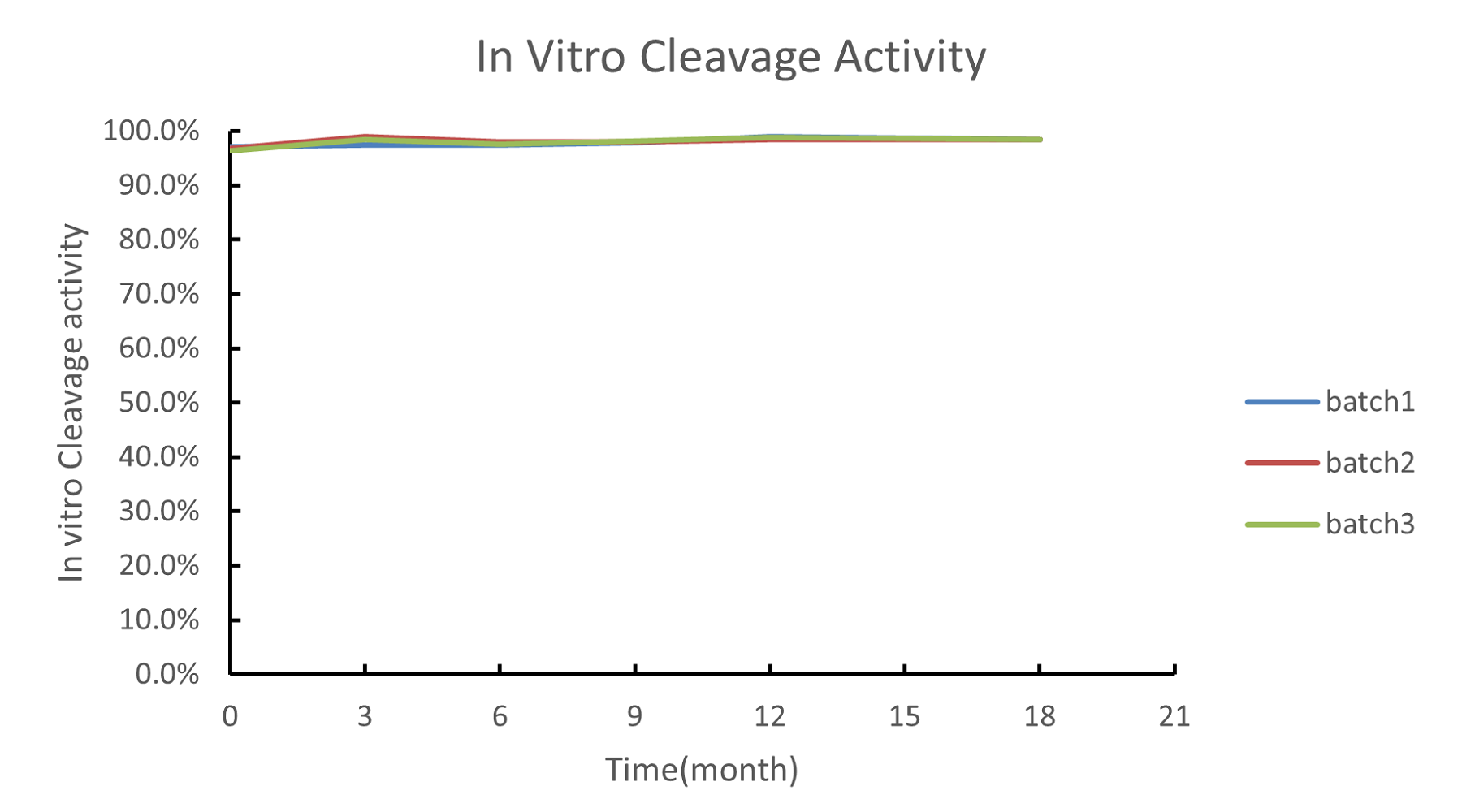
检测三批Cas9核酸酶的长期稳定性数据(0~18个月)。检测项有SEC-HPLC、RP-HPLC、In vitro cleavage activity等。
结果显示: Cas9核酸酶的稳定性和批间一致性表现良好





